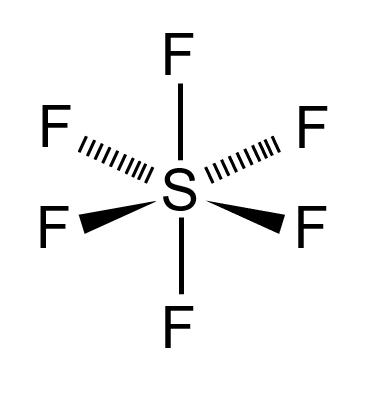
De acordo com a quantidade de átomos, ligações e elétrons livres as moléculas podem adquirir diferentes geometrias. Na molécula do SF6, há sete átomos: um átomo de enxofre ligado a seis átomos de flúor. Dessa forma, todos os elétrons da camada de valência do enxofre estão participando das ligações químicas com o flúor e não há nuvem eletrônica. Portanto, a molécula de SF6 tem a seguinte representação:
A) INCORRETA - Na geometria tetraédrica é necessária a presença de 5 átomos, cujo átomo central não apresenta elétrons não ligantes e se liga a outros 4 átomos.
B) CORRETA - Conforme mostrado na imagem acima, a geometria da molécula do SF6 é octaédrica, pois são 7 átomos, sendo que o enxofre é o átomo central (sem a presença de elétrons não ligantes) ligado a outros 6 átomos de flúor.
C) INCORRETA - Na geometria bipiramidal são necessários 6 átomos, cujo átomo central, que não apresenta elétrons não ligantes, se liga a outros 5 átomos.
D) INCORRETA - Nessa geometria são necessários 5 átomos, com o átomo central ligado a outros 4 átomos, que estão localizados no mesmo plano (há a presença de elétrons livres no átomo central).
E) INCORRETA - Nessa geometria são necessários 6 átomos, cujo átomo central está ligado a 4 átomos em um mesmo plano e a outro átomo em um plano diferente, formando uma pirâmide quadrangular (há a presença de elétrons livres no átomo central).
Gabarito do Professor: Letra B.