-
Ka1= [H3O+].[HS-] / [H2S] => Ka1 = [H3O+]^2 / 0,1 ==> [H3O+] = 10^-4 = [HS-]
Logo em Ka2, a [H3O+] e [HS-] se anulam:
Ka2 = [H3O+].[S2-] / [HS-] => Ka2 = [S2-] = 10-13 mol/L
Certo!
-
O H2S, quando em contato com água, libera íons H3O+ em solução, como mostrado nas equações abaixo:
H2S + H2O ⇋ H3O+ + HS- Ka1 = 1,0 ∙ 10-7
HS- + H2O ⇋ H3O+ + S2- Ka2 = 1,0 ∙ 10-13
De acordo com a concentração de H2S fornecida (0,100 mol/L), para o primeiro equilíbrio, temos que:
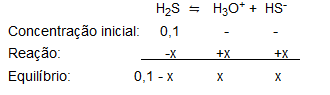
Dessa forma,
Ka1 = [H3O+] ∙ [HS-]/[H2S] = x ∙ x/(0,1 - x)
Como o H2S é um ácido fraco, é possível utilizar a consideração que x é um valor muito pequeno (0,1 - x ≈ 0,1), logo:
Ka1 = x ∙ x/0,1 ∴ 1,0 ∙ 10-7 = x2/0,1 ∴ x = (1,0 ∙ 10-8)1/2 ∴ x = 0,0001 mol/L
Para o segundo equilíbrio, temos que:
Ka2 = [H3O+] ∙ [S2-]/[HS-]
Ka2 = x ∙ [S2-]/x ∴ Ka2 = [S2-] = 1,0 ∙ 10-13 mol/L
Portanto, a concentração de [S2-] é inferior a 1,0 ∙ 10-10 e o item está correto.
Gabarito do Professor: CERTO.
-
H2S + H2O ----> H3O+ HS- ka1 = 1,0 × 10-7
HS- + H2O ------>H3O+ S2- ka2= 1,0 x 10-13
ka1 = [ H3O+][HS-]/ [H2S] ... 1,0 × 10-7 = x^2 / 0,1 = 1,0x10-4 ---> [HS- ] = [H3O]
ka2 = [H3O][S2-]/ [HS- ] ...
---> [S2-] = 1,0 x 10-13
-
Vamos lá:
O H2S é um ácido fraco.
H2S --> H+ + HS- Ka1 = 10^-7
0,1-X X X
0,1- X é a quantidade de H2S que tinha no início menos a quantidade que foi ionizada formando H+ e HS-
Só que como esse ácido é fraco, nós podemos fazer uma aproximação e considerar [H2S] como sendo 0,1.
Logo,
[H+] . [HS-]
Ka1= -----------------
[H2S]
X . X
10^-7= -------------- --> X^2 = 10 ^-8 X = raiz quadrada de 10 ^-8 --> X = 10^-4 = [HS-] = [H+]
0,1
HS- --> H+ + S2- Ka1 = 10^-13
10^-4 10^-4 + X X
Consideramos a concentração de H+ é 10 ^-4, porque essa concentração vem da primeira ionização e a essa quantidade deve ser somada a quantidade que será formada nessa segunda ionização, mas a quantidade é tão pequena que podemos desconsiderar. Logo,
10^4 . X
10^-13= ----------------- --> X = 10^-13 = [S2-].
10^-4
Como 10^-13 é menor que 10^-10 o item está correto.