-
Essa questão fala do gás carbônico (dióxido de carbono - CO2) no ciclo biogeoquímico do carbono, que é utilizado para a fotossíntese, e retorna para a atmosfera através da respiração, queima, decomposição e fermentação.
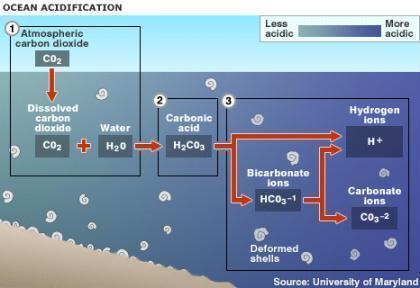
Um dado importante trazido no enunciado é o gás ser facilmente solubilizado em água. A grande quantidade de dióxido de carbono no ambiente pode aumentar a temperatura do planeta, ameaçar espécies sensíveis e afetar o pH dos oceanos. Como o gás se solubiliza na água, ele é dissolvido no mar e passa por transformações químicas, produzindo CO2 aquoso e ácido carbônico (H2CO3), liberando H+ no oceano, diminuindo assim seu pH e aumentando a acidificação no oceano. (Linhares, S. & Gewandsznajder, F. Biologia. São Paulo: Ática, 2011)
Fonte da imagem: Site ecodebate.com.br
Considerando as propriedades descritas, o aumento atmosférico da substância afetará os organismos aquáticos em razão da
a) redução do potencial hidrogeniônico da água. O aumento de CO2 afeta os organismos aquáticos, pois ele é dissolvido no oceano, diminuindo o potencial hidrogeniônico (pH baixo - acidificação dos oceanos). CORRETA.
b) restrição da aerobiose pelo excesso de poluentes. Esse aumento do dióxido de carbono dissolvido não interfere na respiração aeróbica dos organismos. Incorreta.
c) diminuição da emissão de oxigênio pelos autótrofos. O dióxido de carbono dissolvido não diminui a emissão de O2, os autótrofos emitem em mesma quantidade. A acidez que afeta os organismos. Incorreta.
d) limitação de transferência de energia entre os seres vivos. A alimentação dos organismos poderia ser comprometida em algum momento pelo aumento da acidez no mar, porém a transferência de energia não é atingida. Incorreta.
e) retração dos oceanos pelo congelamento do gás nos polos. O dióxido de carbono não influencia na retração dos oceanos, ele altera o pH do mar. Incorreta.
Gabarito do professor: Letra A.
-
GABARITO: A
O AUMENTO DO CO2 NA ATMOSFERA LEVA O AUMENTO DA CONCENTRAÇÃO DE ACIDO CARBÔNICO EM AMBIENTE AQUÁTICO. COM ESSE AUMENTO HAVERÁ LIBERAÇÃO DE"IONS" QUE LEVAM A REDUÇÃO DO PONTENCIAL DE HIDROGÊNIO.
-
Questão referente ao fenômeno da acidificação dos oceanos.
Esse processo funciona da seguinte maneira.
Com o aumento da emissão do diôxido de carbono na atmosfera, seja por meio da queima de combustiveis fosseis, seja por meio dos derivados industriais, o oceano acaba sendo um destinatário para tal gás.
O Co2, ao entrar em contato com a água, H2O, produz o acido carbônico
Co2 + H2O <<<<>>>> h2Co3
Esse acido é bastante instável, fraco, o que promove a desestabilização da sua ligação química, liberando o ion bicarbonato em água, (HCO3-) e, posteriormente, íons carbonatos, além do mal feitor: prótons H+. Sabemos que uma solução ácida tem uma alta concentração de íons de hidrogênio H+, ou seja, esses ambientes se tornam acidificados.
A questão queria essa relação, contudo trouxe o nome por extenso da tabela ph, isto é, potencial hidrogeniônico. Nessa tabela, quanto maior for a redução do seu nível, mais acido é o ambiente. Logo, resposta letra A
-
Letra A
-O aumento do CO2 atmosférico promove aumento da concentração desse gás no meio aquoso. Nos corpos d`água, o CO2 reage com a H2O formando ácido carbônico que reduz o pH do meio.
-
A grande quantidade de dióxido de carbono no ambiente pode aumentar a temperatura do planeta, ameaçar espécies sensíveis e afetar o pH dos oceanos. Como o gás se solubiliza na água, ele é dissolvido no mar e passa por transformações químicas, produzindo CO2 aquoso e ácido carbônico (H2CO3), liberando H+ no oceano, diminuindo assim seu pH e aumentando a acidificação no oceano.
-
Com a maior concentração do Dióxido de Carbono (CO2) na atmosfera, e próximo ao ambiente aquático. aumentam as reações entre a água e o CO2 originando Ácido Carbônico, que por mais que seja um ácido fraco, reduz o ph da água na região tornando-o mais ÁCIDO (com maior concentração de H+) e que está muito relacionado com a corrosão dos esqueletos calcários (oriundos do carbonato de cálcio CaCO3) de poríferos como os corais
-
se ele tivesse abreviado pra PH mais pessoas tinham acertado haha