Letra C.
Para responder, vamos buscar os conhecimentos da Teoria de Ácido-base de Bronsted.
Meios aquosos, onde liberam o e liberam , esta foi mais além, mostrando que o de hidrogênio é o responsável pelo caráter ácido-básico
- Ácido é toda espécie química doadora de prótons H.
- Base é toda espécie química receptora de prótons H.
https://www.infoescola.com/quimica/acidos-e-bases-de-bronsted-lowry/
Para a resposta, De acordo com essa definição, é evidente, que ambos coexistam na forma de par conjugado ácido-base, ou seja, obrigatoriamente a base recebe o próton doado pelo ácido, caso contrário não se aplica a teoria.
reação 1: HCO2H (l) + H2O (l) ⇌ H3O+ (aq) + HCO2 – (aq)
Acido Base (Ac.conjugada da base no reagente) ( Base conj. do acido do reagente)
HCO2H é acido de bronsted porque doa um H+ para H2O, logo, H2O é base porque recebe H+ do acido (CO2H).
H3O+ é o acido conjugado do H2O, porque agora ele tem um H na estrutura (instável) que pode doar, por isso é um acido, so que conjugado da base, o HCO2 – é um base conj. do HCO2H, pois pode receber um H.
TODO ACIDO TEM UMA BASE CONJUGADA
TODA BASE TEM UM ACIDO CONJUGADA..
A reação 2 é no mesmo sentido.
Esta questão
está relacionada à teoria ácido-base de Bronsted-Lowry.
De acordo com essa teoria, o ácido é toda espécie que doa prótons H+,
enquanto que a base é toda espécie química que recebe prótons H+. Dessa
forma, são formados os pares conjugados:
Dessa forma,
para as reações 1 e 2, temos os seguintes pares conjugados:
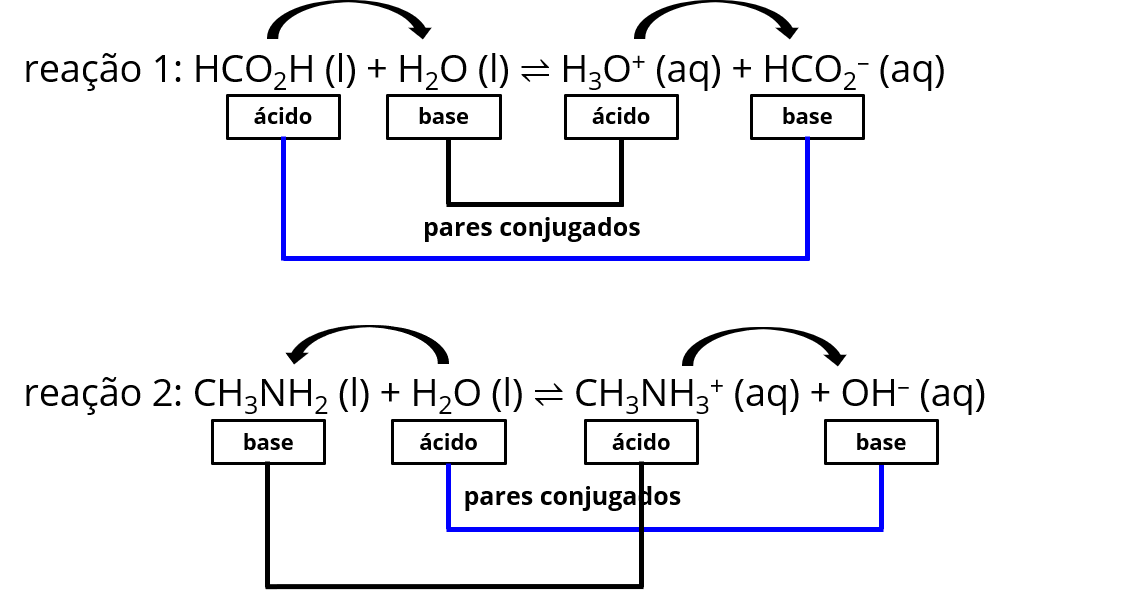
O enunciado requer, considerando a reação direta, o reagente ácido e sua base conjugada, ou
seja, os que estão indicados acima pela linha azul (reagente ácido se encontra antes da seta e sua respectiva base conjugada após a seta):
reação 1: HCO2H/HCO2-
reação 2: H2O/OH-
Gabarito da Professora: Letra C.