Esta questão abrange conceitos relacionados à reação de oxirredução. Esse tipo de reação acontece quando há transferência de elétrons, a substância que sofre redução recebe elétrons e a substância que sofre oxidação doa elétrons. De acordo com as reações de redução fornecidas, a prata (Ag) possui maior potencial de redução do que o cobre (Cu). Dessa forma, a prata sofrerá redução e o cobre oxidação, gerando a seguinte reação global:
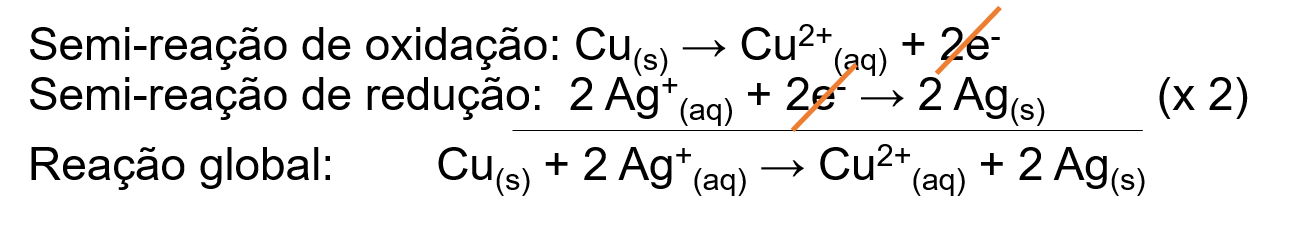
A) ERRADA - De acordo com a reação global mostrada, o cobre vai de Cu0(s) a Cu2+(aq), formando Cu(NO3)2, entretanto, esse sal é solúvel em água, não havendo formação de precipitado, mas sim de Cu(NO3)2(aq).
B) CORRETA - De acordo com a reação global mostrada, a prata vai de Ag+(aq) a Ag(s). Dessa forma, ocorre deposição da prata metálica (Ag(s)) sobre o fio de cobre.
C) ERRADA - Conforme explicado na alternativa B), ocorre deposição de prata metálica e não de sal de prata.
D) ERRADA - De acordo com a reação global mostrada, o cobre metálico sofre oxidação.
E) ERRADA - De acordo com a reação global mostrada, os íons prata sofrem redução.
Gabarito do Professor: Letra B.