Esta questão envolve conceitos de titulometria.
Dessa forma, é importante saber que numa titulação, a concentração de um
composto ou solução desconhecidos é determinada por meio de outra solução com
concentração conhecida. O ponto de equivalência é o momento em que o titulante
(solução de concentração conhecida) reage completamente com o titulado (solução
de concentração desconhecida). Nas titulações são utilizados indicadores ácido-base
para perceber a mudança de cor e saber o momento em que o ponto de equivalência
foi atingido e registrar o volume do titulante necessário. Com base nesses
conceitos, observemos os dados fornecidos e a resolução da questão:
Dados:
V (HClO4) = 25,0 mL =
0,025 L
M (HClO4) = 0,01 mol/L
V (NaOH) = 24,85 mL = 0,02485 L
M (NaOH) = 0,01 mol/L
Resolução:
1) A reação que acontece nesta titulação
é a seguinte:
NaOH (aq) + HClO4 (aq) →
NaClO4 (aq) + H2O (l)
É possível perceber, observando a
reação, que temos uma relação 1:1 entre o NaOH e o HClO4. Dessa
forma:
n (HClO4) = n (NaOH)
M (HClO4) ∙ V (HClO4) = M (NaOH) ∙ V (NaOH)
2) Como as molaridades são iguais, o
volume necessário de NaOH para que ocorra uma reação completa é de 25,0 mL. No enunciado é dito que a titulação parou com um volume de 24,85 mL de NaOH, logo, antes do ponto equivalência ser atingido. Dessa forma, primeiramente é preciso calcular o número de mols das espécies:
n (HClO4)inicial =
M (HClO4) ∙ V (HClO4) ∴ n (HClO4)inicial =
0,01 ∙ 0,025 = 0,00025 mols
n (NaOH)inicial = M (NaOH) ∙ V (NaOH) ∴ n (NaOH)inicial = 0,01 ∙ 0,02485 = 0,0002485 mols
3) Como a reação é 1:1, tem-se que:
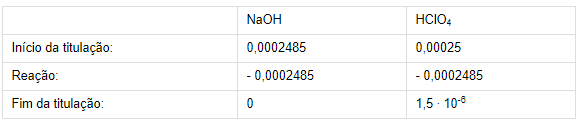
4) A concentração de [H+] após
a reação é proveniente do número de mols de HClO4 que não reagiu:
[H+] = n (HClO4)final/Vtotal
[H+] = 1,5 ∙ 10-6/ (0,025 + 0,02485) = 1,5 ∙ 10-6/0,04985
[H+] = 3,0 ∙ 10-5 mol/L
5) A partir de [H+] é possível
calcular o pH:
pH = - log [H+]
pH = - log (3,0 ∙ 10-5) = - [log (3) + log (10-5)] = - (0,48 – 5) =
4,52
6) Por fim, o erro de titlação é dado
pela seguinte expressão:
Erro de titulação = (Vponto final –
Vponto de equivalência) ∙ 100 /Vponto de equivalência
= (24,85 – 25,00) ∙ 100 /25,00
Erro de titulação = -0,6%
Portanto, o pH é igual a 4,52 e o erro
de titulação igual a -0,6%.
Gabarito do Professor: Letra B.
Dica: como é difícil saber o log de
números como 3 sem o uso da calculadora, é possível supor o valor final do pH
pelo log de 10-5, que é igual a - 5. Dessa forma, como o log de 3
com certeza é < 1,0, pode-se perceber que o valor do pH será um pouco menor
que 5, o que nos leva à alternativa B.
Gabarito do professor: Letra B.