-
LETRA A
-
Com a retirada da ureia, a proteína espontaneamente retorna a estrutura terciária correta, pois foram fornecidas condições favoráveis à sua conformação nativa, o que garante a estabilidade da molécula. Desse modo, a leucina e valina aminoácidos alifáticos (hidrofóbicos) voltarão a se agrupar no interior da molécula.
-
Letra A
Os aminoácidos Leucina e Valina são apolares, propriedade permite interações hidrofóbicas que influenciam na estrutura terciária de uma proteína, estando dispostos no interior de proteínas que se encontram em ambiente aquoso.
A Uréia (CH4N2O) atua como agente desnaturante, prejudicando as interações hidrofóbicas e desorganizando as estruturas secundária e terciária das proteínas (sem hidrolisar as ligações peptídicas, não alterando a estrutura primária). Com a remoção da uréia, a proteína retoma sua estrutura original, posicionando cadeias laterais hidrofóbicas no interior da estrutura e cadeias laterais hidrofílicas no exterior (meio aquoso).
Portanto, a proteína estava em meio aquoso, e as cadeias laterais dos aminoácidos são hidrofóbicas.
-
Questão fala de uma proteína de 40 aminoácidos desnaturada pela exposição da ureia, e após a ureia ter sido retirada, ela voltou ao seu estado original, com as cadeias de leucina e valina agrupadas no interior. Questiona-se a explicação para a proteína voltar ao estado original após ter sido desnaturada. Quando proteínas (união de aminoácidos) são colocadas em altas temperaturas, em pH diferente ou em contato com certos solutos como a ureia, sofrem alterações na sua configuração espacial, e sua atividade biológica é perdida, caso em que ocorre a desnaturação da proteína. Um aminoácido se liga a outro por meio de ligações covalentes (peptídicas), e a desnaturação não afeta as ligações covalentes/peptídicas. Alguns solventes orgânicos como o etanol, ureia e detergentes agem diretamente no núcleo das proteínas globulares, desestabilizando a parte hidrofóbica. Geralmente, as proteínas se tornam insolúveis quando se desnaturam, mas algumas proteínas desnaturadas podem voltar ao seu estado original, se forem expostas às condições nativas para sua atividade. (Amabis & Martho. Fundamentos da Biologia Moderna. São Paulo: Moderna, 1991)
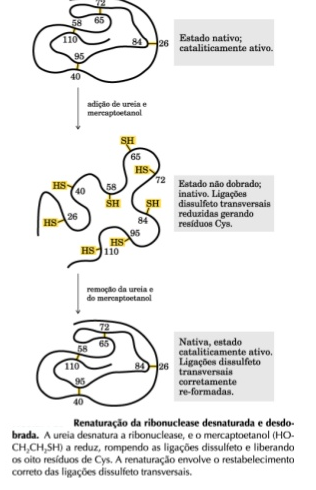
A explicação para esse fato é:
a) a proteína estava em meio aquoso, e as cadeias laterais dos aminoácidos são hidrofóbicas. As cadeias laterais formadas por valina e leucina são hidrofóbicas e estavam em meio aquoso. CORRETA.
b) a retirada da ureia permitiu a recomposição das ligações peptídicas entre os aminoácidos. A ureia desestabiliza as partes hidrofóbicas, não quebra as ligações peptídicas. Incorreta.
c) as cadeias laterais dos aminoácidos formaram ligações iônicas com a porção N-terminal da proteína. Essas cadeias laterais foram desestabilizadas e alteraram sua morfologia, não ocorrendo ligações iônicas. Incorreta.
d) as ligações duplas entre os carbonos da cadeia principal dos aminoácidos promoveram o reenovelamento da proteína. A proteína voltou ao seu estado original pela retirada da ureia, componente que desestabilizou a valina e leucina, estabilizando novamente essas partes hidrofóbicas. Incorreta.
e) as cadeias laterais desses aminoácidos formaram ligações covalentes entre si. As cadeias laterais não realizam ligações covalentes no caso da questão. Incorreta.
Gabarito do professor: Letra A.
-
Interações hidrofóbicas (forças de Van der Waals) ocorrem entre cadeias de aminoácidos apolares, como: leucina, valina, isoleucina, alanina e fenilalanina.
Nos pontos em que ocorrem as interações hidrofóbicas, a cadeia sofre uma "dobra" para o interior da estrutura, impedindo o contato dessa porção com a água.
-
A Quantidade de proteínas interfere na resposta? Ao invés de 40 é 60.