-
I - 2Ca3(PO4) + 6SiO2 + 10C ---> 6CaSiO3 + 10CO + 1P4
Equação Balanceada, somando os coeficientes = 35
Correto.
II - Silício pertence a familia 4A, com isso ele tende a doar seus 4 elétrons. Como os oxigênios tendem a receber cada um 2 elétrons, irão fazê-lo com os 4 do Si. Dessa forma, pela geometria molecular, verifica-se que Não sobram elétrons livres na estrutura do silício. Assim sendo, consta-se que o número de ligações(2 duplas) é o mesmo que o número de átomos iguais que estão ligados ao Si(2 Oxigênios), o que torna a molécula apolar/linear, e não angular conforme é apresentado pela questão.
Errada.
III - Distribuindo-se as cargas e encontrando os NOX dos elementos, é possível verificar que o Cálcio é quem sofre redução(Agente Oxidante) e o Carbono é quem sofre oxidação(Agente Redutor), e não o SiO2 conforme é apresentando pela questão.
Errada.
IV - Distribuindo-se as cargas e encontrando os NOX dos elementos, é possível verificar que de fato o Carbono sofre oxidação.
Correto.
-
Esta questão abrange os conceitos de reações de oxirredução e geometria molecular. Dessa forma, observemos a análise das afirmativas:
I- Balanceamento por oxirredução:
1) Identificar os compostos que apresentam variação no número de oxidação (NOX). Como o C e o P variam entre substâncias compostas e simples no reagente e no produto eles apresentam variação no NOX:
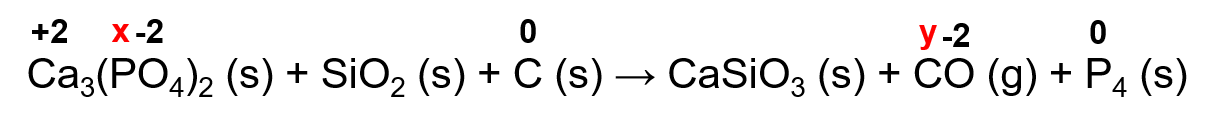
P - NOX no reagente: 3 · (+2) + 2 · x + 8 · (-2) = 0 ∴ 2 · x = 16 - 6 ∴ x = 10/2 ∴ x = +5
NOX no produto: 0 (substância simples)
Variação no NOX = 5 - 0 = 5. Como tem-se 2 P no reagente a variação total é igual a 2 · 5 = 10
C - NOX no reagente: 0 (substância simples)
NOX no produto: y - 2 = 0 ∴ y = +2
Variação no NOX = 2 - 0 = 2. Como tem-se 1 C no produto a variação total é igual a 1 · 2 = 2
Logo, o carbono sofre oxidação (aumento no NOX) e o fósforo sofre redução (diminuição no NOX).
3) O total de elétrons cedidos será o coeficiente (número que fica na frente da fórmula na reação) do elemento que sofre redução e o total de elétrons recebidos será o coeficiente do elemento que sofre oxidação:

4) Com os coeficientes dos elementos que sofreram redução e oxidação, prosseguir com o balanceamento por tentativas:
Como o coeficiente do Ca3(PO4)2 no reagente é 2, isso totaliza 6 Ca, logo, é preciso colocar um 6 na frente do CaSiO3. Com isso, são 6 Si no produto, logo, é preciso colocar um 6 na frente do SiO2 no reagente. Com o coeficiente 10 do C no reagente basta colocar um 10 na frente do CO no produto. Dessa forma, a equação fica:
2 Ca3(PO4)2 + 6 SiO2 + 10 C → 6 CaSiO3 + 10 CO + 1 P4
Soma dos coeficientes: 2 + 6 + 10 + 6 + 10 + 1 = 35
Portanto, essa afirmativa está correta.
II - O Si pertence ao grupo 4 da tabela periódica, dessa forma, possui 4 elétrons na última camada e faz quatro ligações. Logo, o Si, que é o átomo central, não possui par de elétrons não ligantes que causariam repulsão e uma diminuição no ângulo característica da geometria angular. Portanto, essa afirmativa é incorreta. A molécula de SiO2 possui geometria linear, assim como a molécula de CO2, já que o C e o Si pertencem ao mesmo grupo da tabela e possuem ambos 4 elétrons na última camada: O = Si = O.
III - O agente redutor é a substância que sofre oxidação e por isso promove a redução de outro composto. Dessa forma, a substância que sofre oxidação (tem seu NOX aumentado do reagente para o produto) é o C(s). Portanto, essa afirmativa está incorreta, uma vez que o Si e o O não sofrem alteração em seu NOX.
IV - Como observado na afirmativa I, o carbono (C) tem seu NOX aumentado do reagente para o produto (vai de 0 a +2), ou seja, é um doador de elétrons. Dessa forma, esse elemento sofre oxidação. Portanto, essa afirmativa está correta.
Portanto, as afirmativas I e IV estão corretas.
Gabarito do Professor: Letra E.
-
E de EsPCEX
:P
-
2 Ca(P04)2 + 6Si02 + 10C ------> 6CaSiO3 + 10CO+ 1 P4
soma dos coeficientes = 35
-
III – O agente redutor do processo é o dióxido de silício. - ERRADO
Agente redutor é quem se oxida = carbono (anula a III e responde a IV)
IV – Neste processo ocorre a oxidação do carbono. - CERTO
Gab: E
-
Acerca deste processo, são feitas as seguintes afirmativas:
I – Após o balanceamento da equação por oxidorredução, a soma dos coeficientes estequiométricos é igual a 35.
2Ca3(PO4) + 6SiO2 + 10C ---> 6CaSiO3 + 10CO + 1P4
Equação Balanceada, somando os coeficientes = 35
II – O dióxido de silício é uma molécula que apresenta estrutura de geometria molecular angular. Primeiro dióxido de silício não seria uma molécula, mas sim um solido covalente e segundo o mesmo possui geometria linear já que não contém pares de elétrons não ligantes no átomo central.
III – O agente redutor do processo é o dióxido de silício. FALSO, o agente redutor é o carbono olhando o nox do silício você nota que ele se mantem inalterado na reação enquanto o carbono sair de 0 para +2, logo se lembre Agente Redutor é aquele que oxida ,ou seja, que aumenta o nox
IV – Neste processo ocorre a oxidação do carbono. Explicação no tópico III.
-
DICA: na III ele diz que o agente redutor é um e na IV diz que o que oxida é outro, logo as duas não podem estar certas e voce pode eliminar as alternativas que eles estao juntos